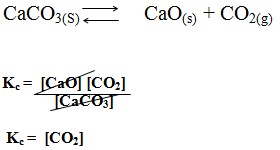Um equilíbrio químico é a situação em que a proporção entre as quantidades de reagentes e produtos em uma reação química se mantém constante ao longo do tempo.
Teoricamente, toda a reação química ocorre nos dois sentidos: de reagentes se transformando em produtos e de produtos se transformando de volta em reagentes.
Reações Reversíveis e o estado de equilíbrio
Inúmeras reações que ocorrem no nosso dia a dia são irreversíveis, ou seja , os reagentes se rearranjam formando produtos e a reação ocorre num só sentido. A reação de glicose e oxigênio que produz água e gás carbônico é um exemplo de reação irreversível.
C6H12O6 –> CO2 + H2O
No entanto, algumas reações químicas não adotam o mesmo comportamento, e por isso são chamadas de reversíveis. Nesse caso não há apenas uma reação ocorrendo num só sentido, e sim, duas reações que acontecem simultaneamente, onde reagentes originam produtos pela reação direta e produtos originam reagentes pela reação inversa.
As reações direta e inversa ocorrem em velocidades diferentes, mas tendem a se igualar. Quando ambas as velocidades das reações direta e inversa se tornam iguais, e, portanto, as concentrações de todas as substâncias da reação permanecem constantes, diz-se que a reação atingiu seu equilíbrio químico.
Quando uma reação reversível atinge o equilíbrio químico, a relação dos produtos e reagentes é constante (o que não quer dizer que isso ocorra em proporção de 1 : 1 necessariamente), o que recebe o nome de constante de equilibrio. A constante de equilíbrio pode ser expressa em termos das concentrações em mol/L (Kc), em que não entram os sólidos, ou em termos de pressão parcial (Kp), em que somente os gases.
Através do valor da constante de equilíbrio, é possível obter a relação dos reagentes e produtos, assim, se Kc ou Kp forem iguais a 1, a concentração dos reagentes e dos produtos é igual, se maiores que 1, a concentração dos produtos é maior que a dos reagentes (reação de alto rendimento), e, por fim, se menores que 1, a concentração dos reagentes é maior que a dos produtos (baixo rendimento de reação).
O equilíbrio pode ser classificado em homogêneo e heterogênio. Equilíbrio homogêneo se dá quando todos os reagentes e produtos estão num mesmo estado, seja ele líquido, sólido, gasoso ou aquoso. O heterogênio, ao contrário, ocorre quando existem substâncias em estados diferentes.
Onde Kc representa o valor das constantes de equilíbrio em uma temperatura determinada , em função da concentração da espécies em mol L -1 ou [ ] mol L-1 . Em caso da ocorrência da reação em fase gasosa, a constante é comumente expressa Kp, em função das pressões parciais das espécies presentes no equilíbrio.
Exemplo: Reação onde as espécies apresentam-se em fase gasosa no equilíbrio:
Para a reação genérica a abaixo:
As substâncias presentes no equilíbrio podem estar em diferentes estados físicos (líquido, sólido e/ou gasoso), formando um equilíbrio heterogêneo nesse caso a constante K não considera, as concentrações do líquidos e sólidos puros, uma vez que, nesse contexto a sua variação de concentração será desprezível.
Como exemplos temos a reação de calcinação do Carbonato de Cálcio, dada por:
Como o [CO2] é uma espécie em fase gasosa podemos relacionar as constantes Kc eKp de acordo com equação mencionada a seguir:
Kp = Kc . RT (Δn)
Onde:
- Kp é a constante de equilíbrio em função da pressão.
- Kc é a constante de equilíbrio em função da concentração.
- R é a constante de Boltzman ou seja R= 0,082 L atm-1
- T é temperatura em Kelvins(K) onde K= T em °C + 273,15
- Δn é a variação do número de mols ou seja Δn = (n produto)-(n reagentes)